C2 軸で1/2 回転しても元通りだが,2つの鏡映面のどちらかで反転すると符号が反転→ A2という対称性に分類される(※水分子には該当する軌道は存在しない) C2 軸で1/2 回転したり,xy平面に対し反転すると符号が反転.yz 平面での反転だとそのまま→ B1という対称.. 分子軌道法(MO法)による共有結合の理解. 4.1 分子軌道法の基本的な考え方. 4.2 等核二原子分子の分子軌道. 4.3 異核二原子分子の分子軌道. 4.3.1 HF. 4.3.2 CO. 1. 軌道の形はこう描かれる. 軌道関数の位相+、ーに絶対 的な意味はありません。.

原子の構造と核分裂 - 原子力発電 | 電気事業連合会
原子核の陽子の数に着目した、新しい周期表「ニュークリタッチ」 大学ジャーナルオンライン
2.5 2原子分子とHOMOとLUMO スペクトル色々
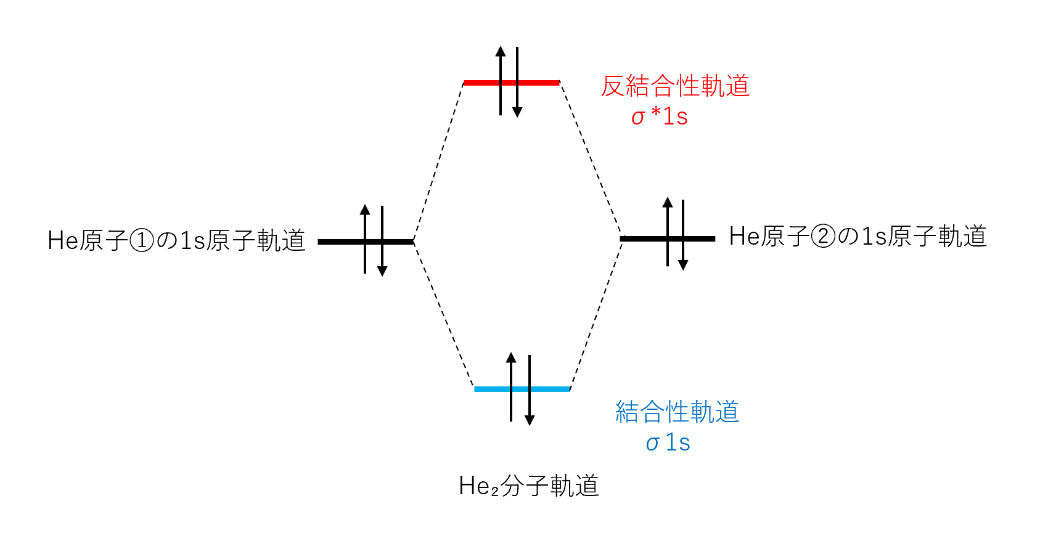
2原子分子の分子軌道理論【原子軌道から分子軌道をつくる】 三毛猫の実験室
電子はどのように存在している?原子の電子配置について|高校化学をスキマ時間でわかりやすく
P112

【無機化学 20 】異核二原子分子とヘモグロビンと一酸化炭素中毒の理由 「12分で納得」 YouTube
研究内容
-2048x981.png)
【中学3年】原子の構造を理解すればイオンが完璧に理解できる!【原子とイオンの関係とは!?】 理科の授業をふりかえる


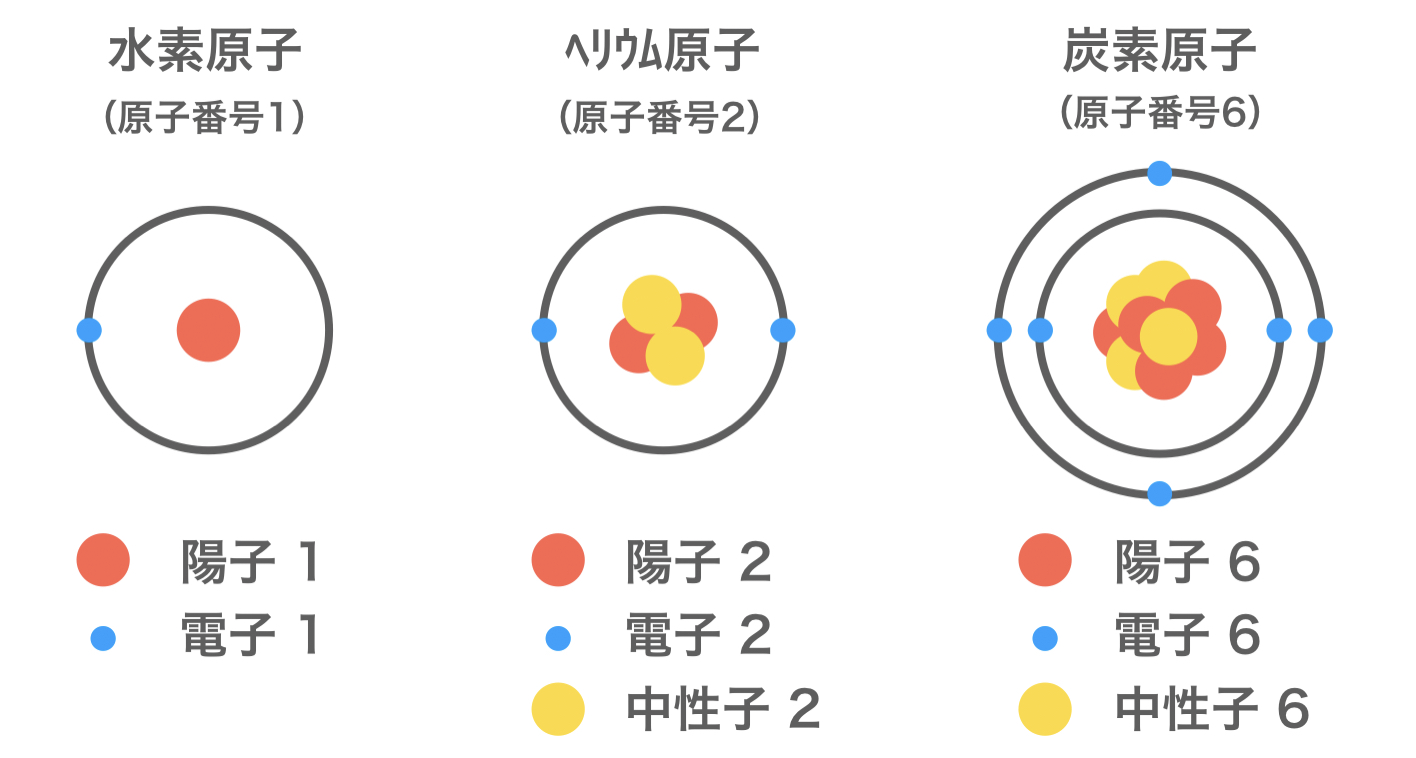
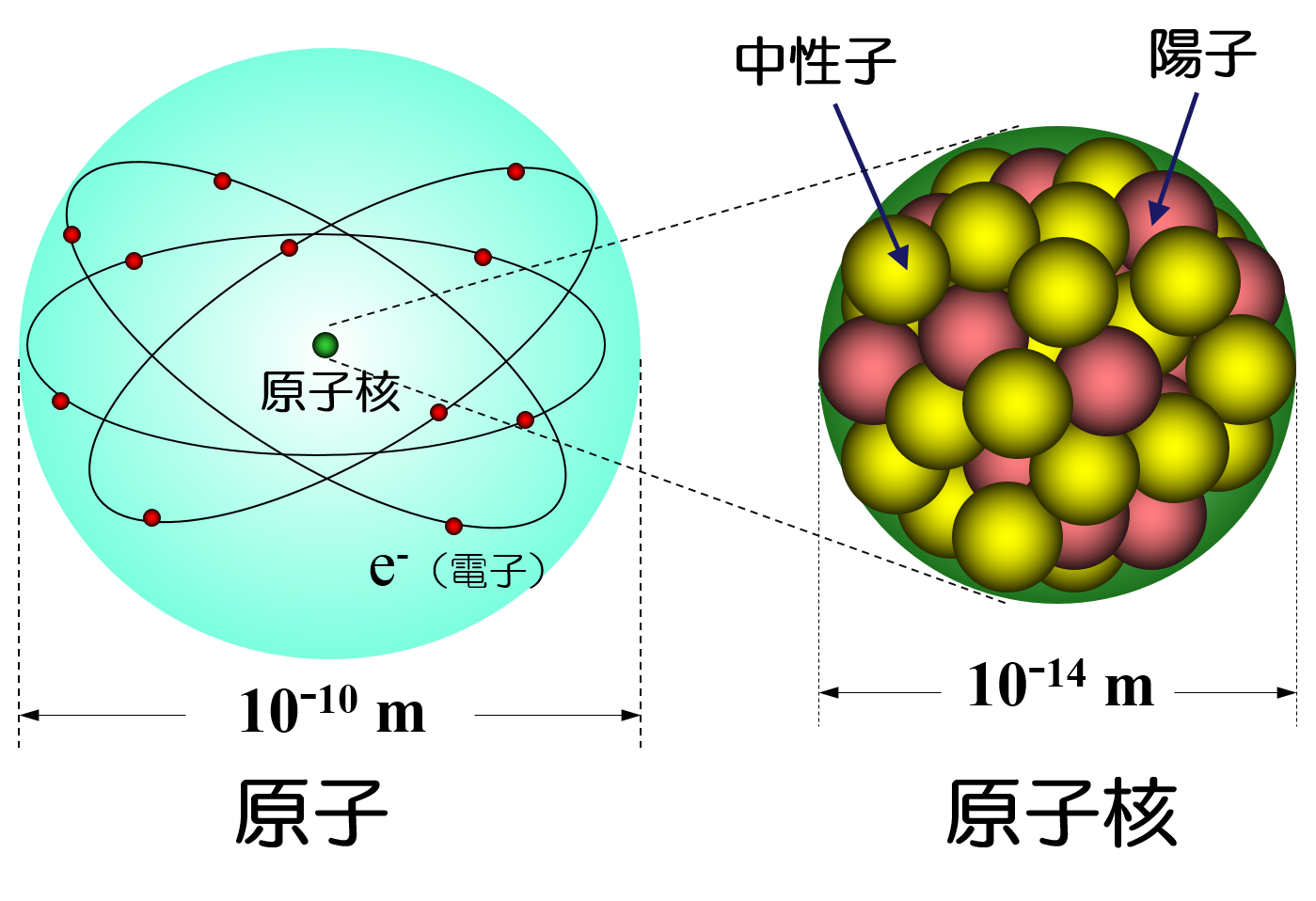
原子と原子核の構造をわかりやすく図解してみた 化学受験テクニック塾

量子是什么?与分子、原子、电子有什么关系?

原子軌道(電子軌道)から電子配置・電子スピンまで【s軌道,p軌道, d軌道】 化学のススメ
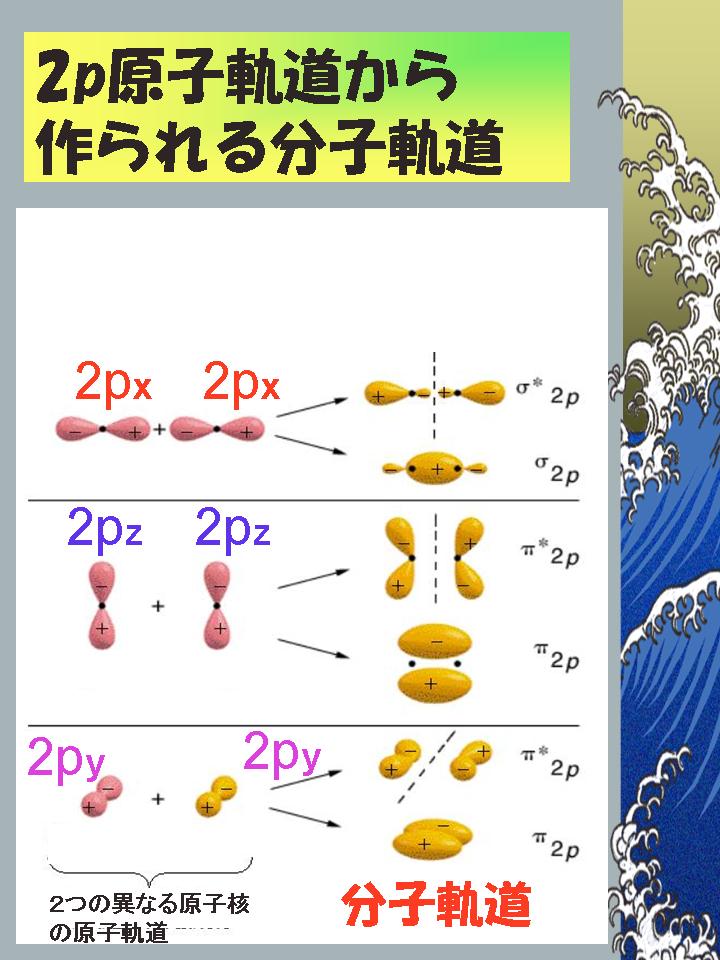
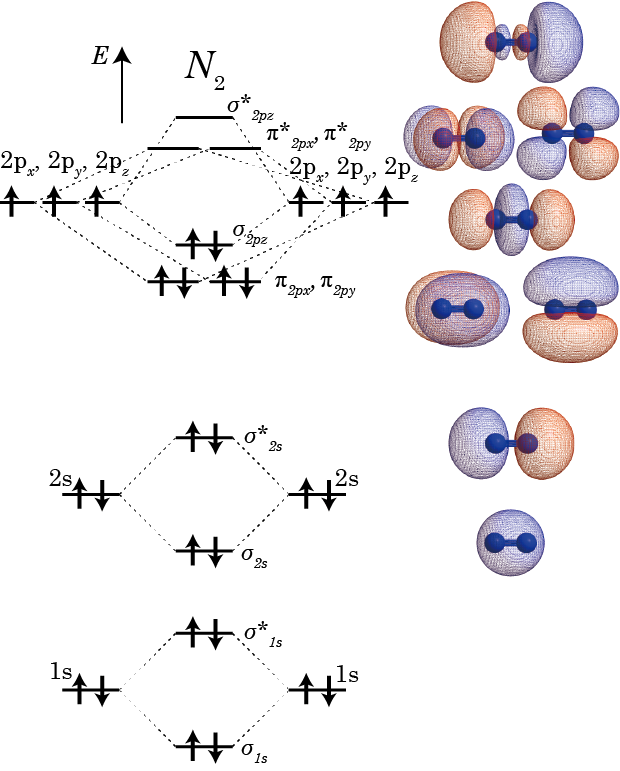
第11講義 2原子分子のMO(2) 酸素分子と窒素分子 blogchemistry

Q&A
原子核 快懂百科

Web教材イラスト図版工房 / 化学変化と原子・分子

5分で分かる「二原子分子」量子化学を使って分子が作られる理由を考えよう!京大卒の研究者がわかりやすく解説! ページ 2 StudyZ
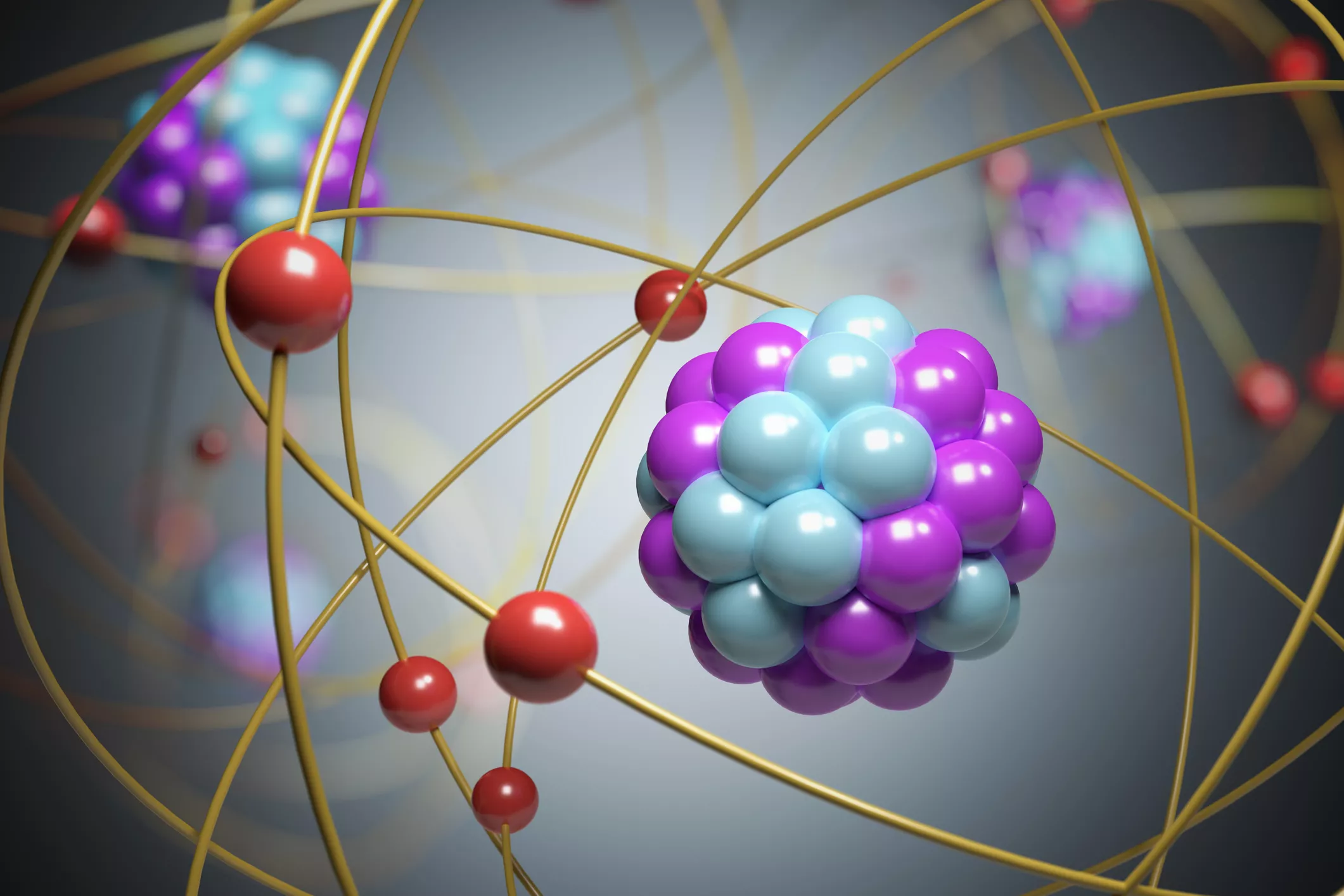
如何从通俗地理解「原子核」的结构,它是如何被发现的? 知乎

結晶場理論の考え方と電子の高スピン・低スピン配置 化学徒の備忘録(かがろく)化学系ブログ
1. 担当教員:福井大学大学院工学研究科生物応用化学専攻准教授. 教科書:アトキンス物理化学(第8版)、東京化学同人. 10章原子構造と原子スペクトル. 11章分子構造. 前田史郎. E-mail:[email protected]. URL:http://acbio2.acbio.u-fukui.ac.jp/phychem/maeda/kougi. 6月3 日自習問題11・6 Cl のイオン化エネルギーは13.1eVである.HCl分子におけるシグマオービタルのエネルギーを求めよ. Ψ 0.62 = − ⎩Ψ ⎪ ⎨ H ⎪ + +. Cl. 0.79 Ψ , E = − 13 . 1 −. +. 1.28 = − 14 .4eV. −. H. Cl. E = −. −.. 分子軌道 (ぶんしきどう)または 分子オービタル ( 英: Molecular orbital 、略称: MO)は、 分子 中の各 電子 の波の様な振る舞いを記述する一電子 波動関数 のことである。 分子軌道法 において中心的な役割を果たし、電子に対する シュレーディンガー方程式 を、 一電子近似 を用いて解くことによって得られる。 1個の電子の位置ベクトル の関数であり、 と表される。 原子 に対する 原子軌道 に対応するものである。 この関数は、特定の領域に 電子 を見い出す確率といった化学的、物理学的性質を計算するために使うことができる。